 www.ciensacion.org | Los experimentos prácticos de Ciensación están publicados como Recursos Educativos Abiertos bajo la licencia internacional Creative Commons Attribution-ShareAlike 4.0 International License.
www.ciensacion.org | Los experimentos prácticos de Ciensación están publicados como Recursos Educativos Abiertos bajo la licencia internacional Creative Commons Attribution-ShareAlike 4.0 International License.
Una demostración segura y simple de un catalizador.
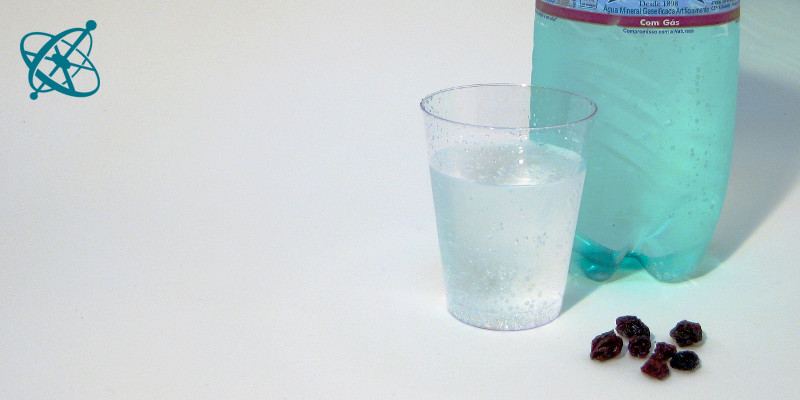
Solo necesitas agua con gas...

... y unas pasas de uva «flotantes».
Pasas de uva flotantes
Los experimentos más comunes de catálisis se hacen con fuego o reacciones bioquímicas complejas con enzimas. Si estás buscando una forma segura de explicar este concepto y que a la vez sea una actividad práctica con la velocidad justa para que el fenómeno pueda ser observado, bastan algunas pasas de uva o granos de arroz sumergidos en agua con gas.
Un catalizador facilita o aumenta la velocidad de una reacción química sin sufrir alteraciones.
Agua con gas
Pasas de uva
Coloca algunas pasas de uva en un vaso de agua con gas.
1. ¿Qué provoca que las pasas de uva suban y se hundan?
2. ¿Qué reacción química ocurre en la superficie de las pasas de uva? ¿Qué función cumplen las pasas de uva en esta reacción?
3. ¿Se produce una alteración de las pasas de uva con esta reacción química?
(si es necesario)
¿Qué son esos pequeños puntos plateados que aparecen en la pasa de uva al caer al agua?
› Pequeñas burbujas de aire.
¿De dónde proviene el gas que hace que el agua sea efervescente?
› Es el CO2 que fue disuelto en el agua y ahora vuelve al estado gaseoso.
El agua con gas tiene dióxido de carbono (CO2) que se adiciona bajo presión y a baja temperatura para formar ácido carbónico (H2CO3):
CO2 + H2O ⇌ H2CO3
Cuando se reduce la presión (al abrir la botella) o se aumenta la temperatura del agua, el equilibrio químico cambia y el CO2 sube a la superficie en forma de pequeñas burbujas de gas.
Cuando colocamos pasas de uva en agua, esas pequeñas burbujas de aire quedan pegadas en las «arrugas» de su piel. Las burbujas de aire ayudan a la formación de CO2: mientras que el CO2 se vuelve a disolver rápidamente en agua, el CO2 en las burbujas de aire es más propenso a permanecer en estado gaseoso. Así, el gas se acumula en burbujas en la superficie de la pasa de uva y le proporciona capacidad de flotar. Cuando asoman a la superficie del agua, algunas de las burbujas explotan, las pasas de uva pierden flotabilidad y se hunden de nuevo.
Aunque la pasa de uva no sufra transformaciones con la reacción química, la facilita con las pequeñas burbujas de aire pegadas en su superficie. Por eso, este experimento puede considerarse una demostración en cámara lenta de un catalizador.


